La synthèse énantiosélective de l'énantiomère non naturel est nécessaire pour étudier ses propriétés biologiques et son métabolisme. Un exemple de synthèse de la (R)-Nicotine en quatre étapes est ici présenté, il repose sur une réaction d'hydroboration intramoléculaire et de cycloalkylation.
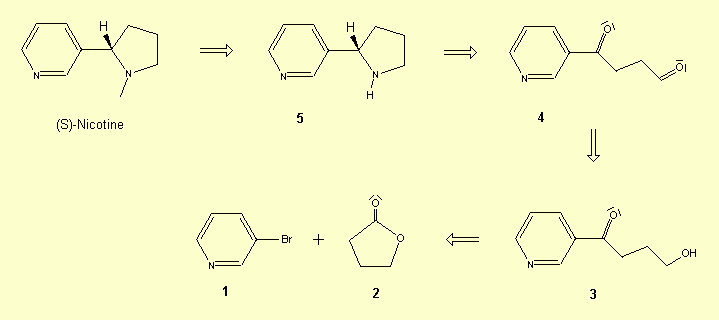
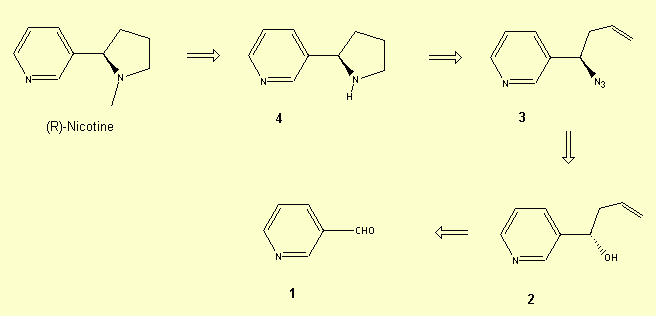
Schéma de rétrosynthèse:
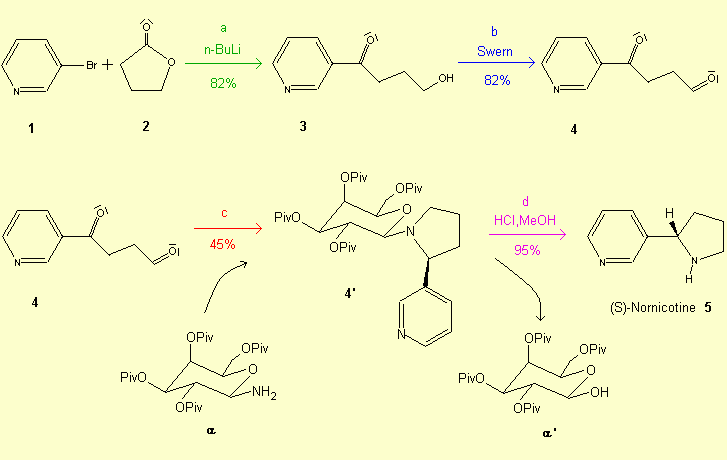
Synthèse[6]:
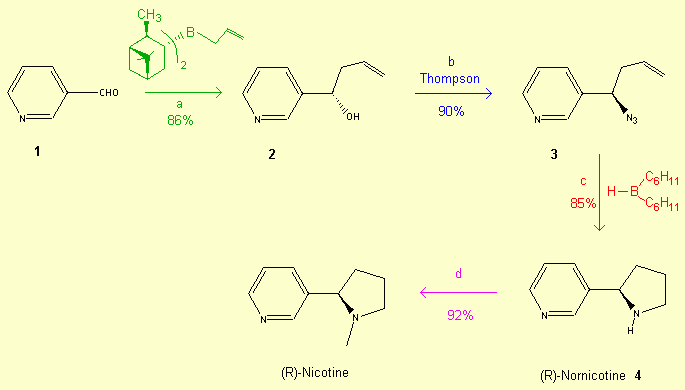
a - On réalise tout
d'abord l'allylation du pyridinecarboxaldéhyde 1 avec 2,2 équivalents
de B-allyldiisopinocampheylborane dans Et2O à -100°C.
Le (S)-homoallylicalcool 2 est alors obtenu avec un rendement de 86% et
un excès énantiomérique de 94%.
b - L'azide chiral 3
est obtenu par la réaction de Thompson avec un rendement de 90% et sans racémisation.
DBU (1,2 équivalents), (PhO)2P(O)-N3 (1,2 équivalents),Toluène
c -
Hydroboration
intramoléculaire et cycloalkylation du composé 3.
2,2 équivalents de B(C6H11)2H dans le THF.
On a d'abord hydroboration de la double liaison de 3, le bore se place sélectivement
sur le carbone le moins substitué. Ensuite, il y a formation d'une liaison bore azote entre le trialkylborane et l'azide. Enfin, la fermeture du cycle s'effectue par migration du carbone 1 vers l'azote
avec perte de diazote.
d - Alkylation de la (R)-Nornicotine 4 en
(R)-Nicotine.
(i) EtOCOCl (1,2 équ.), Et3N (1,3 équ.), Et2O
(ii) LiAlH4 (1,2 équ.), THF, 0°C