|
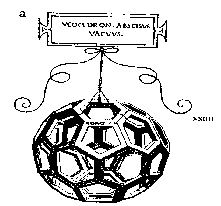
Le Buckminsterfullerene L’autre allotrope de carbone est le buckminsterfullerene, nommé d’après un architecte et inventeur américain Richard Buckminster Fuller qui a créé quelques dômes géodésiques (figure 4),
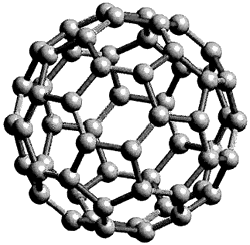
qui ont inspiré la structure du C60 (figure 5). La structure d’un icosahedron régulièrement tronqué était déjà connue par Leonardo de Vinci dans les années 1500 (figure 6).
Une autre interprétation de la même époque était celle d’Albrecht Dürer (figure 7). Au vingtième siècle des solutions théorétiques concernant la symétrie moléculaire d’ensembles la plus élevée a précédé leur découverte expérimentale dans les laboratoires de quelques décennies. Tisza en 1933 a considéré une symétrie moléculaire d’ensembles une pointe group symétrie pour des molécules icosahedraux et en 1970 Osawa a proposé qu’un icosahedron de C60 puisse être stable chimiquement. En 1987 Harry Kroto a écrit un article dans Nature, un journal scientifique, qui expliquait sa découverte du C60, un icosahedron tronqué. Les fullerènes sont une nouvelle famille de non-équilatéraux composées de carbone découverts par des chercheurs à l’Université de Sussex et l’Université de Rice aux Etats Unis. Leurs structures se composent d’hexagones et pentagones un peu comme un ballon de foot, donc ils ont tous des structures fermées en forme de cages de carbone. Chaque carbone a une liaison avec trois autres et son hybridation est sp2 (par contraste l’hybridation du diamant est sp3). Le composé n’est pas aromatique ni super aromatique, la délocalisation des électrons est pauvre et le C60 se comporte comme un alcène qui a une insuffisance en électrons donc il réagit avec des espèces qui sont riches en électrons. La découverte du C60 a été une collaboration entre l’université de Rice et celle de Sussex. Elles ont utilisé la technique de la vaporisation des lasers d’une cible pour produire des clusters d’atomes. Kroto a réalisé que s’ils utilisaient une cible de graphite, les clusters seraient des appareils parfaits pour sonder la formation des chaînes de carbone. En septembre 1985 la technique a sondé le plasma produit par la vaporisation des lasers par la spectrométrie de masse. Les expériences ont confirmé que des clusters ou des chaînes de carbones se formaient. Pendant les expériences on a noté que la coordonnée pour le C60 montrait une grande stabilité. Il est très stable à cause de la configuration des pentagones dans la structure. Il y a cinq affirmations qui ont été présentés dans Nature pour la stabilité de la molécule. La première: est que la valence du carbone est consistante avec les besoins normaux du carbone, donc chaque atome est lié avec trois autres par deux liaisons singulières et une double liaison. Deuxièmement: la mesure de résonance prouve que la molécule est stable et en C60 il y a 12,500 structures de résonance. Des hydrocarbonés avec cinq ou six membres d’une bague sont abondants et stables. Troisièmement: d’après la recherche de W. Barth et R. Lawton il est clair qu’une structure où un pentagone est entouré complètement par des hexagones est stable. Quatrièmement: les structures géodésiques préfèrent des isomers symétriques parce que la tension peut être distribuée également sur tous les atomes. Les structures où la courbure est localisée sont enclins à attaquer au site de la tension. Finalement: des structures électroniques fermées sont préférées. Le C60 alors est le plus petit réseau fermé qui a chaque pentagone séparé l’un de l’autre sans tension. Ainsi le buckminsterfullerene a dominé la chimie des fullerènes. La découverte du buckminsterfullerene a donné en 1996, le prix Nobel de chimie aux professeur Curl et professeur Smalley des Etats-Unis et au professeur Sir Kroto du Royaume Uni.
Accueil ||
Le Diamant ||
Le Graphite ||
C60 ||
Les Nanotubes ||
Les Fullerènes
|
|||||||