|
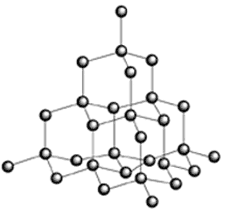
Le Diamant Les allotropes de carbone inclus le diamant, le graphite et le buckministerfullerene. Le diamant est le plus dur et dense, et le moins réactif de tous les allotropes il est incolore. Ces propriétés peuvent être expliquées par l’arrangement et les liaisons des atomes (figure 1).
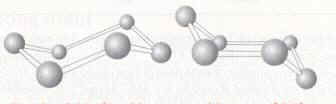
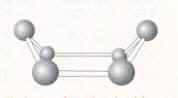
Il existe deux types de diamant, le plus rare a des atomes qui sont disposés très proches l’un de l’autre en une formation en hexagone et le diamant « classique » qui a la structure d’un cube et dont les atomes sont proches les uns des autres. Chaque atome a un nombre de coordination de quatre donc les atomes sont arrangés comme un tétraèdre. Les carbones sont lies avec des liaisons singulières. La différence entre les deux polymorphes est la structure du carbone. Le carbone quand il existe sous forme d’un cycle composé de six atomes de carbone, peut changer sa géométrie selon l’énergie de la molécule et les autres atomes. Il peut avoir la position d’une « chaise » ou un « bateau » (figure 2).
La chaise est plus stable parce que la position a le moins d’énergie, et tous les atomes de carbones dans le diamant cubique ont cette structure. Mais parfois la conformation peut changer et quelques hexagones peuvent rester dans la position d’un bateau ainsi la structure du diamant a changé. Le diamant est un isolant parce que la séparation d’énergie entre la plus haute des couches de valence et le bas de la liaison de conduction est large. On utilise le diamant pour les forets et pour des bijoux bien sur.
Accueil ||
Le Diamant ||
Le Graphite ||
C60 ||
Les Nanotubes ||
Les Fullerènes
| |||||||||||||