|
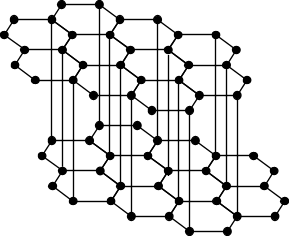
Le Graphite Aussi surprenant que cela puisse paraître, le graphite est le plus stable des allotropes. Le graphite est noir et doux (figure 3).
Figure 3. Le graphite Il comprend une petite différence de couches à cause des orbitales de pi, donc il conduit l’électricité (la conductivité du diamant est 10-18 celle des couches du graphite). Le graphite existe sous deux formes: celle d’un hexagone et d’un rhombe. Les couches des hexagones sont arrangées parallèlement et sont liées par des liaisons de van der Waals. La séparation entre les couches est 3.35 x 10-10m, environ la somme des rayons de van des Waals pour le carbone. Celui-ci indique que les forces entre les couches ne sont pas fortes. Actuellement les couches glissent l’une sur l’autre donc le graphite est un lubrifiant. La différence des structures du graphite est occasionnée par l’organisation des hexagones comme des chaises ou des bateaux. Néanmoins chaque atome a un nombre de coordination de trois donc les atomes sont arrangés en triangle. Les liaisons sont multiples entre les carbones. La structure des couches détendues permet aux molécules et aux ions de pénétrer et former des composés d’intercalation ou lamellar. Quelques composés de lamellar se forment spontanément quand les réactifs sont proches l’un de l’autre
Accueil ||
Le Diamant ||
Le Graphite ||
C60 ||
Les Nanotubes ||
Les Fullerènes
|